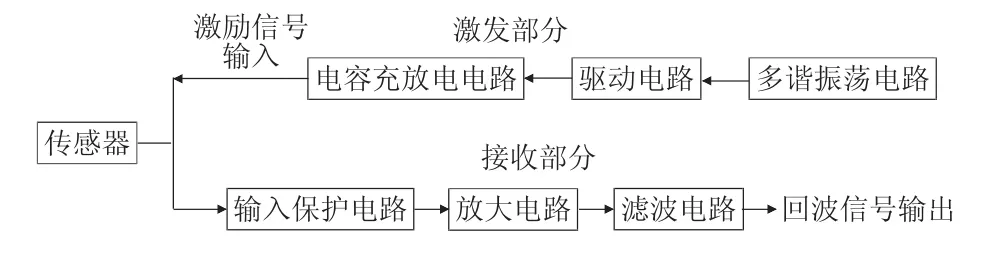
苏文欣, 许凌欣, 姜宛彤, 刘宇乐, 王 菲, 吕亚茹, 严俊鑫
(东北林业大学园林学院, 黑龙江 哈尔滨 150040)
土壤盐碱化严重影响了农林业的发展,并造成巨大的经济损失。我国盐碱地总面积达9 913万hm2,约占全国土地面积的10%[1]。作为我国盐碱地主要分布区域之一的东北地区,其盐碱地总面积已达766万hm2[2],位于东北的松嫩平原更是世界三大苏打盐碱地集中分布区域之一,土壤中盐分以NaHCO3和Na2CO3为主[3]。种子萌发期是植物生长的关键时期,盐碱胁迫会严重抑制植物种子的正常萌发。由于萌发幼苗通常发生在土壤表面,所以种子和早期幼苗相比于成熟植株暴露在盐碱环境中的概率更大[4]。因此,种子萌发期是对盐碱胁迫最为敏感的时期,增强种子萌发时的耐盐碱能力是植物在盐碱地建植的关键[5]。
目前,外源钙、褪黑素(Melatonin,MT)和赤霉素(Gibberellin,GA)缓解植物逆境胁迫的相关研究有很多。钙是植物生长所必须的营养元素,在植物的种子萌发和生长发育过程中发挥重要作用[6],可增强植物对非生物胁迫的抗性[7]。Ca2+可以增加膜结合Ca2+量,提高膜的稳定性,从而对盐碱胁迫下的植物起到一定积极作用[8]。研究表明,低浓度的氯化钙(CaCl2)能够促进黑麦草(Loliumperenne)[9]种子萌发。MT属于吲哚类化合物,能够促进正常生长条件下植物的生长[10],在逆境条件下,MT可以通过促进种子萌发、提高保护酶活性、增加渗透调节物质的积累等提高植物的抗逆性[11]。研究发现,盐胁迫下MT可提敖汉苜蓿(MedicagosativaAohan)[12]和甜叶菊(Steviarebaudiana)[13]的种子发芽率。GA是一种植物内源激素,可以促进植物细胞的生长和分裂,进而促进植物的伸长[14]。在植物种子萌发阶段,GA对打破休眠、促进种子萌发起到了不可或缺的作用[15]。一定浓度的GA可促进薰衣草(Lavandulamairei)[16]和棉花(Gossypiumhirsutum)[17]种子萌发,提高甜玉米(Zeamays)[18]幼苗的抗氧化酶活性和叶绿素含量,缓解盐胁迫。
紫苏(Perillafrutescens)是一年生唇形科紫苏属草本植物,其适应性强,对土壤要求不严,能够在山地、丘陵及盐碱地种植[19]。我国紫苏资源丰富,栽培紫苏的历史悠久,并且在我国北方形成了西北和东北2个传统油用紫苏产区[20]。黑龙江桦南县已经成为栽培籽用紫苏的一大产区[21],被誉为“中国紫苏之乡”。作为气味芳香的彩色叶植物,紫苏在园林绿化中也应用广泛[22]。目前关于紫苏种子的研究主要是化学成分和萌发特性方面,关于缓解盐碱胁迫对紫苏种子萌发影响的研究鲜见报道。本研究以紫苏种子为试验材料,分析了CaCl2,MT,GA对盐碱胁迫条件下紫苏种子萌发、幼苗生长、抗氧化酶活性的影响,以期为紫苏抗盐碱栽培提供参考依据。
1 材料与方法1.1 试验材料
紫苏种子,2021年9月购自蓝翔园艺种苗有限责任公司,室温储藏。净种后千粒重为5.02 g,含水量为8.03%,发芽率为96.67%左右。
1.2 试验方法
选用颗粒饱满、大小均匀的紫苏种子,将种子在5%的过氧化氢溶液中浸泡5 min进行消毒,再用蒸馏水冲洗3~5遍,用滤纸吸干种子表面水分。分别用5种浓度的CaCl2(5,10,15,20,25 mmol·L-1)、MT(25,50,100,200,300 μmol·L-1)、GA(25,50,100,200,300 mg·L-1)浸种24 h,以蒸馏水浸泡24 h的紫苏种子作为对照(对照记为CK,5个浓度梯度分别记为T1,T2,T3,T4,T5),共16个处理,每个处理重复3次。采用培养皿滤纸发芽法[23],将浸种后风干的种子置于铺有2层滤纸直径为9 cm的培养皿内,每个培养皿50粒种子。向培养皿中加入NaCl和NaHCO3按物质的量比例1:1混合[24]的浓度为80 mmol·L-1的胁迫溶液5 mL(溶液浓度根据前期预试验确定,pH 8.36,水势-0.28 MPa),最后用保鲜膜封口,减少水分蒸发。将培养皿置于光照培养箱中进行培养,设置25℃恒温,相对湿度75%,光周期为12 h光照/12 h黑暗,每隔24 h观察并记录紫苏种子萌发情况,第10 d结束发芽试验,取幼苗测定其生长指标。
幼苗生长试验于种子萌发试验后进行,萌发试验结束后将培养皿中的幼苗继续在光照培养箱中培养5 d,之后将出芽15 d的幼苗移栽至穴盘中(泥炭土∶珍珠岩∶蛭石=5∶1∶1),继续进行胁迫处理,采用盆浸法使胁迫溶液完全浸透基质,每个处理重复3次,30株幼苗为一个重复,移入穴盘15 d后取样测定其生理指标。
1.3 测定指标与方法
1.3.1种子萌发指标测定 以胚根长度达到种子长度的1/2为发芽标准,第4 d统计发芽势,第10 d计算发芽率、发芽指数、活力指数。
发芽势(GE)=
(第4 d发芽种子数/供试种子数)×100%;
发芽率(GP)=
(第10 d发芽种子数/供试种子数)×100%;
发芽指数(GI)=∑Gt/Dt;Gt为第t天种子发芽数,Dt为相应的发芽天数;
活力指数(VI)=GI×S;S为胚根长[25]。
1.3.2幼苗生长指标测定 胚根长、胚芽长:每个处理随机取10株幼苗,使用游标卡尺测量出长度,取其平均值,每个处理重复3次。
鲜重:每个处理随机取10株幼苗,用滤纸吸干表面水分,采用称重法测量10株幼苗的总重,每个处理重复3次。
1.3.3幼苗生理指标测定 取幼苗叶片测定其抗氧化酶活性,超氧化物歧化酶(SOD)活性采用氮蓝四唑法[26]测定,过氧化氢酶(CAT)活性采用紫外吸收法[27]测定,过氧化物酶(POD)活性采用愈创木酚法[26]测定。
1.4 数据分析
使用Microsoft Excel 2016进行数据整理,用SPSS 25.0进行数据分析,用Duncan法进行差异显著性检验(P<0.05)。
采用模糊数学隶属函数法,对不同处理下紫苏种子萌发、幼苗生长和生理指标进行综合评价,计算公式为[28]:
X(ij)=(Xij-Xjmin)/(Xjmax-Xjmin)
式中,X(ij)为i处理下j指标的隶属函数值,Xij为i处理下j指标的测定值,Xjmin为j指标的最小观测值,Xjmax为j指标的最大观测值。
2 结果与分析2.1 氯化钙、褪黑素、赤霉素对紫苏种子萌发指标的影响
由表1可以看出,盐碱胁迫下不同浓度外源物质浸种处理对紫苏种子萌发的影响不同。随着3种外源物质浓度的上升,种子的发芽率、发芽势、发芽指数和活力指数呈先升高后降低的趋势。在CaCl2处理中,各项种子萌发指标都在10 mmol·L-1浓度下达到最高值,较CK显著增加(P<0.05)。而20,25 mmol·L-1的CaCl2使种子发芽率较CK稍有降低,表明适宜浓度的CaCl2能够促进盐碱胁迫下紫苏种子萌发,而到达一定浓度后CaCl2反而会对紫苏种子萌发产生抑制作用。MT处理下,除发芽率在300 μmol·L-1浓度较CK稍有降低外,其余萌发指标均高于CK,各项指标均在100 μmol·L-1浓度达到最大值,分别较CK增加了9.68%,16.22%,13.2%,75.75%,差异显著(P<0.05)。不同浓度GA均能够促进紫苏种子萌发。发芽率、发芽势、发芽指数和活力指数均在50 mg·L-1浓度下达到峰值,分别较CK增长了10.48%,18.01%,16.36%,79.2%,差异显著(P<0.05)。在不同浓度的3种外源物质处理中,50 mg·L-1的GA是促进种子萌发的最佳处理。
![图片[1]-不同外源物质对盐碱胁迫下紫苏种子萌发、幼苗生长及生理的影响-游戏花园](https://www.hunggame.com/wp-content/uploads/2025/07/20250710161019-686fe5ebd7af8.webp)
表1 不同浓度CaCl2,MT和GA处理对盐碱胁迫下紫苏种子萌发的影响Table 1 Effects of different concentrations of CaCl2,MT and GA on the germination of Perilla frutescens seeds under saline-alkali stress
2.2 氯化钙、褪黑素、赤霉素对紫苏幼苗生长指标的影响
由图1所示,随着CaCl2和MT浓度的增加,紫苏幼苗的胚根长、胚芽长和鲜重均呈现先升高后下降的趋势;而在GA处理下,除胚根长随GA浓度的增加呈先升后降趋势外,胚芽长和鲜重均逐渐增加。不同浓度的CaCl2均较CK促进了紫苏胚根、胚芽的伸长和鲜重的增加,这3项指标均在10 mmol·L-1处理下达到最高值,分别较CK增加了52.84%,20.59%,40.04%,差异显著(P<0.05)。在MT处理中,与CK相比50~300 μmol·L-1浓度使胚根长显著增加(P<0.05),25~200 μmol·L-1浓度使鲜重显著增加(P<0.05),而胚芽长受MT影响不大。胚根长和鲜重均在100 μmol·L-1浓度下达到最大值,胚芽长则在50 μmol·L-1浓度达到最高值。不同浓度的GA均能使胚根长、胚芽长和鲜重较CK显著增加(P<0.05),3个指标分别较CK增加了32%~54.06%,23.77%~67.74%,44.07%~97.42%。3种外源物质处理中,100 mg·L-1MT是促进盐碱胁迫下紫苏幼苗胚根伸长的最佳处理,300 mg·L-1GA是促进胚芽伸长和鲜重增长的最佳处理。
![图片[2]-不同外源物质对盐碱胁迫下紫苏种子萌发、幼苗生长及生理的影响-游戏花园](https://www.hunggame.com/wp-content/uploads/2025/07/20250710161021-686fe5ed646dc.webp)
图1 不同浓度CaCl2,MT和GA处理对盐碱胁迫下紫苏幼苗胚根长(A)、胚芽长(B)、鲜重(C)的影响Fig.1 Effects of different concentrations of CaCl2,MT and GA on the radicle length (A),embryo length (B) and fresh weight (C) of Perilla frutescens seedlings under saline-alkali stress
2.3 氯化钙、褪黑素、赤霉素对紫苏幼苗抗氧化酶活性的影响
从图2可以看出,在盐碱胁迫下一定浓度的3种外源物质对幼苗的抗氧化酶活性具有促进作用,且随着外源物质浓度的增加,3种酶活性均呈现出先升高后降低的趋势。CaCl2处理中,SOD和CAT活性均在10 mmol·L-1浓度下达到峰值,较CK分别增加了167.34%,198.82%,差异显著(P<0.05)。POD活性在5 mmol·L-1浓度达到最大值,较CK增加31.11%,差异显著(P<0.05)。300 mmol·L-1CaCl2使3种酶活性较CK降低,其中CAT活性较CK降低了55.42%,差异显著(P<0.05)。MT处理中,3种酶均在100 μmol·L-1浓度达到最大值,较CK分别增加了176.1%,241.42%,49.74%,差异显著(P<0.05)。25~100 mg·L-1的GA处理能够显著增加3种酶活性(P<0.05),SOD和CAT活性在50 mg·L-1浓度下达到最大值,而POD活性则在25 mg·L-1浓度下最高。300 mg·L-1GA处理下,POD活性较CK降低了6.67%,差异显著(P<0.05)。3种外源物质浸种处理中,100 μmol·L-1MT是提高紫苏幼苗抗氧化酶活性的最佳处理。
![图片[3]-不同外源物质对盐碱胁迫下紫苏种子萌发、幼苗生长及生理的影响-游戏花园](https://www.hunggame.com/wp-content/uploads/2025/07/20250710161022-686fe5eec8406.webp)
图2 不同浓度CaCl2,MT和GA处理对盐碱胁迫下紫苏幼苗SOD(A)、CAT(B)、POD(C)活性的影响Fig.2 Effects of different concentrations of CaCl2,MT and GA on SOD (A),CAT (B) and POD (C) activities of Perilla frutescens seedlings under saline-alkali stress
2.4 综合评价
为筛选出缓解盐碱胁迫下的最佳处理,采用隶属函数法对不同处理下的10个指标进行综合评价,评价结果如表2所示。不同浓度3种外源物质浸种处理均能够在不同程度上缓解紫苏受到的盐碱胁迫。其中以50 mg·L-1的GA促进效果最好。其次是100 μmol·L-1的MT和10 mmol·L-1的CaCl2,其隶属平均值分别排第2和第3。
![图片[4]-不同外源物质对盐碱胁迫下紫苏种子萌发、幼苗生长及生理的影响-游戏花园](https://www.hunggame.com/wp-content/uploads/2025/07/20250710161024-686fe5f073eef.webp)
表2 不同浓度CaCl2,MT和GA浸种对盐碱胁迫下紫苏种子萌发和幼苗生长的综合评价Table 2 Comprehensive evaluation of seed germination and seedling growth of Perilla frutescens under saline-alkali stress by seed soaking with different concentrations of CaCl2,MT and GA
3 讨论3.1 不同外源物质对盐碱胁迫下紫苏种子萌发和幼苗生长的影响
种子萌发期是植物对盐碱胁迫最敏感的时期,这一时期的耐盐碱能力能够在一定程度上反应该植物对盐碱胁迫的抗性[29]。紫苏在种子萌发和幼苗生长阶段具有较强的耐盐性,能够种植于中度以下的盐渍地[30]。苏银玲等[31]研究发现,紫苏对中性盐NaCl的抗性较强,而对碱性盐NaHCO3和Na2CO3以及混合盐碱的抗性相对较差,当碱性混合盐浓度达到25 mmol/L时就会显著抑制紫苏的种子萌发。本研究中,随着CaCl2浓度的增加,盐碱胁迫下紫苏的种子萌发指标和幼苗生长指标均呈现出先升高后降低的趋势,其中发芽率在20 mmol·L-1和25 mmol·L-1CaCl2处理下较对照降低,这与杜志花等[9]对黑麦草的研究结果一致,CaCl2能促进种子萌发,但高浓度的CaCl2反而会起到抑制作用。可能是由于低浓度的钙离子增强了生物膜的稳定性,而且作为第二信使保证了钙信号通路的正常传导[32],而高浓度的钙离子会导致水势降低,使得种子吸水困难,从而抑制种子萌发[9]。不同浓度处理中,其中以10 mmol·L-1浓度为最佳,这与李永涛等[33]发现10 mmol·L-1CaCl2对促进NaCl胁迫下芦苇(Phragmitesaustralis)种子萌发效果最好的研究结果一致。
MT广泛存在于植物中,能够促进种子萌发和胚根生长[11]。本研究不同浓度MT处理下,紫苏种子的发芽势、发芽指数、活力指数、胚根长、鲜重都较对照增加,而种子发芽率和胚芽长在最高浓度300 μmol·L-1处理下较对照略有下降,且随着MT浓度上升,各项指标均呈先升后降的趋势,其中以100 μmol·L-1为最佳处理浓度,这与熊艳丽等[34]对MT缓解扁穗雀麦(Bromuscatharticus)盐胁迫的研究结果一致。已有研究表明,这种MT对种子萌发和幼苗生长表现出低浓度促进高浓度抑制的现象普遍存在于多种植物中[35],可能原因是过高浓度的MT诱导蛋白质氧化变性,从而导致活性氧积累,使胁迫加剧[5]。
GA与脱落酸(ABA)具有拮抗作用,能够打破由ABA积累导致的休眠,促进种子萌发[36]。本次试验中,不同浓度GA浸种均促进了紫苏种子萌发和幼苗生长。其中除胚芽长和鲜重随GA浓度升高而不断增加外,其余各指标均呈先增后减的趋势,这与张丽丽等[37]发现NaCl胁迫下耐盐水稻(Oryzasativa)品种长白9号种子萌发指标和主胚根长随GA浓度增加而出现先升后降,而芽长不断增加的研究结果一致。其原因可能是过高浓度GA扰乱了种子内部正常的生理代谢,使得其缓解效果变差[27]。胚芽的不断伸长则表明,植物的不同部位对GA的敏感度不同。
3.2 不同外源物质对盐碱胁迫下紫苏幼苗抗氧化酶活性的影响
正常情况下,植物体内活性氧含量能够维持平衡,逆境胁迫会使植物细胞产生过量的活性氧自由基(ROS),对植物的正常生长发育有很大不良影响。保护酶系统可以通过消除过量的自由基,从而保护植物的细胞膜。SOD,CAT,POD等是保护酶系统中的重要成分。施加外源钙能够诱导EnFeSOD,EnCAT2,EnAPX等与抗氧化酶相关的基因的表达,提高抗氧化酶活性,清除盐碱胁迫导致细胞内过量积累的活性氧[38]。本研究中,随着CaCl2,MT,GA浓度增加,盐碱胁迫下紫苏幼苗的3种酶活性都呈现出先升高后下降的趋势。CaCl2浸种处理中,5~15 mmol·L-1的CaCl2均能显著提高3种抗氧化酶活性,以10 mmol·L-1为最佳浓度,这与张春平等[39]研究发现NaCl胁迫下,10 mmol·L-1CaCl2是提高紫苏幼苗抗氧化酶活性的最佳浓度一致。
MT不仅能有效清除ROS,其与活性氧反应产生的代谢物N1-乙酰基-N2-5-甲酰基-甲氧基犬尿胺、2-羟基褪黑素、环3-羟基褪黑素等也可以作为有效的抗氧化剂[40]。添加的外源MT主要通过上调SOD,CAT,POD,APX等基因的表达,提高抗氧化酶活性,抵抗盐碱环境引起的氧化胁迫[35]。本试验中,50~200 μmol·L-1MT浸种能够显著提高紫苏幼苗抗氧化酶活性,且在100 μmol·L-1浓度下达到峰值。这与范海霞等[41]研究MT缓解NaCl对金盏菊(Calendulaofficinalis)幼苗胁迫的结果一致。盐胁迫下褪黑素可以显著提高紫花苜蓿(Medicagosativa)[42]幼苗的POD和SOD活性,但对CAT活性影响不大。以上相关研究表明一定浓度的褪黑素能够通过提高抗氧化酶活性来缓解盐碱胁迫对植物幼苗生长的抑制作用,但是不同植物对其响应不同。
NaCl胁迫下GA可以提高板蓝根(Isatisindigotica)[43]和番茄(Lycopersiconesculentum)[44]幼苗的抗氧化酶活性,缓解胁迫对植物带来的氧化损伤,促进幼苗生长。本研究中,不同浓度GA均提高了SOD,CAT,POD的活性,其中25~100 mg·L-1浓度处理下的3种抗氧化酶活性较对照显著提高,以50 mg·L-1为最佳处理浓度。朱秀红等[45]对3种泡桐研究发现,GA增强毛泡桐(Paulowniatomentosa)抗氧化酶活性的最佳浓度是400 mg·L-1,白花泡桐(Paulowniafortunei)和台湾泡桐(Paulowniakawakamii)的最佳浓度为600 mg·L-1,这表明,植物种类不同,提高抗氧化酶活性所需的GA浓度不同,另外,处理方法和盐碱胁迫中盐分类型和浓度都会影响GA的最佳处理浓度。
4 结论
紫苏对混合盐碱的抗性不强,盐碱胁迫会抑制其种子萌发和幼苗生长,而通过施用外源激素可以缓解这一胁迫。本研究表明,CaCl2,MT和GA都能够促进盐碱胁迫下紫苏的种子萌发和幼苗生长,且随处理浓度的增加,种子萌发和幼苗生长指标以及抗氧化酶活性均呈先上升后下降的趋势。其中10 mmol·L-1CaCl2,100 μmol·L-1MT和50 mg·L-1GA处理可以显著促进紫苏的各项指标。隶属函数分析结果显示,50 mg·L-1GA浸种是缓解盐碱胁迫下紫苏种子萌发和幼苗生长的最佳处理。在以NaCl和NaHCO3为主的盐碱地种植紫苏时,可以使用50 mg·L-1GA对紫苏种子进行预处理,提高其在盐碱地的出苗率、促进幼苗生长。